Прошлое, настоящее и будущее антибиотиков
Содержание:
- Рассмотрим сами антибактериальные препараты с точки зрения характера, спектра и механизма их действия:
- В каком году изобрели пенициллин
- Каким же образом происходит обезвреживание? Существует несколько механизмов действия антибиотиков:
- Конфликт интересов: врачи хотят быстро, пациенты хотят сразу, фармкомпании и аптеки хотят прибыль, но супербаги диктуют свои правила
- Миф. Тетрациклины традиционно «слабые» антибиотики, значительно менее мощные, чем пенициллины
- Пенициллины:
- Доктор, что со мной будет?
- Значение пенициллина в медицине и последствия его открытия
- ГРУППЫ АНТИБИОТИКОВ
- Антибиотики — принципы действия
- После антибиотиков
- Антибиотики надо принимать с осторожностью
- Правила приёма антибиотиков
- Миф. Чтобы вылечиться побыстрее, нужны «сильные» антибиотики широкого спектра действия
Рассмотрим сами антибактериальные препараты с точки зрения характера, спектра и механизма их действия:
Антибиотики воздействуют непосредственно на этиологический фактор, и по характеру действия бывают бактериостатические и бактерицидные:
- Бактериостатические препараты тормозят рост и размножение микроорганизмов. Они не вызывают их гибели. При этом допускается, что механизмы имунной защиты в состоянии самостоятельно справиться с уничтожением и эллиминацией микробов. К бактериостатическим препаратам относятся: макролиды, клиндамицин, стрептограмины, хлорамфеникол, тетрациклины.
- Бактерицидные препараты приводят к гибели микроорганизмов, организму необходимо лишь обеспечить их выведение. К ним относятся: бета-лактамные антибиотики, аминогликозиды, фторхинолоны, гликопептиды и другие (триметоприм, метронидазол, рифампицин и т.д).
В каком году изобрели пенициллин
Официальная дата общенародного признания антибиотика – 1928 год. Однако такого рода синтетические вещества были выявлены и раньше – на внутреннем уровне. Изобретатель антибиотиков – Александр Флеминг, но за это почетное звание могли посоперничать европейские, отечественные ученые. Шотландцу удалось прославить свое имя в истории, благодаря этому научному открытию.
Запуск в массовое производство
Поскольку открытие было официально признано в период Второй Мировой войны, очень сложно было наладить производство. Однако все понимали, что с его участием можно спасти миллионы жизней. Поэтому в 1943 году в условиях боевых действий серийным выпуском антибиотических средств занялась ведущая американская компания. Таким способом удалось не только сократить показатели смертности, но и увеличить продолжительность жизни мирного населения.
Применение в годы второй мировой войны
Такое научное открытие было особенно уместно в период боевых действий, поскольку люди тысячами умирали от гнойных ран и масштабного заражения крови. Это были первые эксперименты на людях, которые давали устойчивый терапевтический эффект. После окончания войны производство таких антибиотиков не просто продолжилось, но и в разы повысилось по объемам.
Каким же образом происходит обезвреживание? Существует несколько механизмов действия антибиотиков:
- Нарушение синтеза клеточной стенки путем ингибирования синтеза пептидогликана (пенициллин, цефалоспорин, монобактамы), образования димеров и переноса их к растущим цепям пептидогликана (ванкомицин), синтеза хитина (никкомицин). Антибиотикам, действующим по данному механизму, присущ бактерицидный характер действия, они не действуют на покоящиеся клетки и L-формы (лишенные клеточной стенки) бактерий.
- Нарушение функционирования мембран из-за нарушения их целостности, образования ионных каналов, связывания ионов в комплексы, растворимые в липидах и нарушения их транспортировки (нистатин, грамицидины, полимиксины).
- Подавление синтеза нуклеиновых кислот: ДНК (стрептомицин, гризеофульвин, рифампицин, рифамицин, ванкомицин) и РНК (брунеомицин, рубомицин, оливомицин).
- Нарушение синтеза белка клеткой (тетрациклины, макролиды).
- Нарушение синтеза пуринов и пиримидинов (азасерин, саркомицин).
- Ингибирование дыхательной цепи (антимицины, олигомицины).
Конфликт интересов: врачи хотят быстро, пациенты хотят сразу, фармкомпании и аптеки хотят прибыль, но супербаги диктуют свои правила
Как только лекарство станет легально доступным, его необходимо презентовать врачам и системам здравоохранения. Однако сегодня фармацевтические фирмы обязаны направлять усилия на то, чтобы специалисты знали о новом лекарстве, но не выписывали антибиотик, пока он не станет крайней мерой.
Это необходимо, чтобы предотвратить появление новой лекарственной устойчивости. Но такой подход серьезно ограничивает прибыльность нового препарата, поэтому антибиотики уже печально известны своей низкой рентабельностью по сравнению с другими лекарствами.
В нынешних условиях ни одна фармацевтическая компания не может рассчитывать на возмещение огромных затрат на разработку новых антибиотиков. Большинство крупных фирм, оснащенных для клинических испытаний, уже ушли из арены именно из-за этой причины.
Миф. Тетрациклины традиционно «слабые» антибиотики, значительно менее мощные, чем пенициллины
Правда. На самом деле тетрациклины имеют широкий спектр антибактериальной активности, причем современные их представители действуют в отношении еще большего количества бактерий, чем их предшественники, включая ряд возбудителей, устойчивых к другим классам антибиотиков. Так, тигециклин, появившийся на рынке только в середине 2000‑х, был разработан в рамках программы по борьбе с растущей антибиотикорезистентностью таких «сложных» в этом плане возбудителей, как золотистый стафилококк и кишечная палочка .
Тетрациклины, в том числе и применяемые на протяжении десятилетий тетрациклин и доксициклин, способны проникать внутрь клетки, поэтому они и сегодня широко применяются для лечения внутриклеточных инфекций, передающихся половым путем (хламидиоза, уреаплазмоза, микоплазмоза). К показаниям к их назначению относится и хеликобактерная инфекция — в составе эрадикационной терапии. Благодаря эффективности в отношении Propionibacterium acne тетрациклины наряду с макролидами применяются для лечения угревой болезни. Миноциклин, чей спектр включает Neisseria meningitidis, используется для профилактики менингококковой инфекции .
В качестве ложки дегтя следует упомянуть и о том, что для большинства тетрациклинов (за исключением современных представителей) свойственны высокий уровень вторичной резистентности многих бактерий и к тому же перекрестная устойчивость микроорганизмов . И это, несомненно, во многих случаях снижает их актуальность.
Пенициллины:
Бензилпенициллин
Старейшая, но не теряющая своей актуальности группа. Являются β-лактамным антибиотиками и имеют в своей структуре четырехчленное β-лактамное кольцо. В свою очередь делятся на природные (биосинтетические) – выделяемые определенными штаммами плесневых грибов, и полусинтетические – получаемые путем лабораторной модификации.
По механизму действия все пенициллины являются бактерицидными, они блокируют финальные этапы синтеза пептидогликана и тем самым приводят к гибели бактерий. Это в свою очередь и объясняет низкую токсичность пенициллинов для человека, клеткам которого не характерен синтез пептидогликана. Для воздействия на бактерии, которые, путем синтеза ферментов β-лактамаз, приобрели устойчивость, были созданы комбинированные с клавулановой кислотой (ингибитором β-лактамаз) препараты. По классическим источникам, имеют достаточно широкий спектр действия, а полусинтетические, благодаря кислотоустойчивости и защищенности от β-лактамаз расширяют его в разы. Но, ввиду растущей резистентности микроорганизмов, пенициллины не всегда производят достаточный лекарственный эффект.
Классификация:
Биосинтетические
- натриевая, калиевая и новокаиновая соли бензилпенициллина
- пролонгированные (Бициллин-3, Бициллин-5, Ретарпен)
- феноксиметилпенициллин
Полусинтетические
- Ампициллин (Г- >Г+)
- Оксациллин (устойчив к пенициллиназе, кислотоустойчив)
- Ампиокс (Ампициллин + Оксациллин)
- Амоксициллин (кислотоустойчив, торговые наименования – Амоксициллин, Амоксил-КМП, Бактокс, Грамокс, Оспамокс, Флемоксин, Хиконцил, Э-Мокс).
- Амоксициллин + клавулановая кислота (амоксиклав)
Пенициллины обладают самой низкой токсичностью в ряду антибиотиков. Основными побочными действиями являются аллергические реакции (крапивница, отек Квинке, анафилактический шок), расстройства со стороны ЖКТ (тошнота, рвота, диарея, при использовании ампициллина и ингибиторозащищенных – псевдомембранозный колит). Отдельные виды могут вызывать гиперкалиемию (чаще бензилпенициллина-К-соль), гипернатриемию (чаще бензилпенициллина-Na-соль), неаллергическую макулопапулезную (ампициллиновую) сыпь, так же болезненность в месте введения, анемию, тромбоцитопению, нейтропению, транзиторную гематурию у детей.
Лекарственные взаимодействия
Пенициллины нельзя смешивать в одном шприце или в одной инфузионной системе с аминогликозидами ввиду их физико-химической несовместимости.
При сочетании ампициллина с аллопуринолом возрастает риск «ампициллиновой» сыпи.
Применение высоких доз бензилпенициллина калиевой соли в сочетании с калийсберегающими диуретиками, препаратами калия или ингибиторами АПФ предопределяет повышенный риск гиперкалиемии.
Требуется соблюдать осторожность при сочетании пенициллинов, активных в отношении синегнойной палочки, с антикоагулянтами и антиагрегантами ввиду потенциального риска повышенной кровоточивости. Не рекомендуется сочетать с тромболитиками.
Следует избегать применения пенициллинов в сочетании с сульфаниламидами, так как при этом возможно ослабление их бактерицидного эффекта.
Холестирамин связывает пенициллины в ЖКТ и уменьшает их при приеме внутрь.
Пероральные пенициллины могут понижать эффективность пероральных контрацептивов за счет нарушения энтерогепатической циркуляции эстрогенов.
Пенициллины способны замедлять выведение из организма метотрексата за счет ингибирования его канальцевой секреции.
Доктор, что со мной будет?
Антибактериальные препараты вам справедливо назначат чаще всего при циститах, кожных инфекциях, затяжных синуситах и пневмониях; самая частая детская болячка для антибиотиков — отит. Это не значит, что нужно кричать на врача при лечении антибиотиками сепсиса, нет.
Побочки
- Самая частая побочка — антибиотик-ассоциированная диарея, которую полюбили считать набившим оскомину дисбактериозом, подробнее см. .
- Иногда бывает такая серьёзная неприятность как глухота: бывает и так, что по анализам бактерии не валятся ничем кроме ушесжигающего антибиотика, но это можно попробовать избежать — достаточно попросить врача назначить Дексаметазон 0,6 на килограмм веса (разделить на три приёма) в течение трёх дней до приёма антибиотиков. Такой лайфхак нельзя применять при тяжёлых инфекциях, где использование кортикостероидов убьёт раньше, чем снизится слух.
- Частенько бывают случаи буйства грибка кандиды, которая в норме есть везде, но из-за уничтожения окружающих бактерий обретает смелость вылезти в виде кандидоза.
Значение пенициллина в медицине и последствия его открытия
Антибактериальное вещество плесневого гриба, выделенное Александром Флемингом и усовершенствованное Флори, Чейном и Хитли, стало основой для создания множества различных антибиотиков. Как правило, каждый препарат активен в отношении определённого вида болезнетворных бактерий и бессилен против остальных. Например, пенициллин не эффективен против палочки Коха. Тем не менее, именно разработки первооткрывателя позволили Ваксману получить стрептомицин, ставший спасением от туберкулёза.
Эйфория 50-х годов прошлого века по поводу открытия и массового производства «волшебного» средства казалась вполне оправданной. Грозные заболевания, столетиями считавшиеся смертельными, отступили, и появилась возможность существенно улучшить качество жизни. Некоторые учёные столь оптимистично смотрели в будущее, что предрекали даже скорый и неминуемый конец любым инфекционным заболеваниям. Однако даже тот, кто придумал пенициллин, предупреждал о возможных неожиданных последствиях. И как показало время, инфекции никуда не исчезли, а открытие Флеминга можно оценивать двояко.
Положительный аспект
Терапия инфекционных заболеваний с приходом в медицину пенициллина изменилась радикально. На его основе были получены препараты, эффективные против всех известных возбудителей. Теперь воспаления бактериального происхождения лечатся довольно быстро и надёжно курсом инъекций или таблеток, а прогнозы на выздоровление почти всегда благоприятны. Значительно снизилась детская смертность, увеличилась продолжительность жизни, а смерть от родильной горячки пневмонии стала редчайшим исключением. Почему же инфекции как класс никуда не исчезли, а продолжают преследовать человечество не менее активно, чем 80 лет назад?
Отрицательные последствия
На момент обнаружения пенициллина было известно много разновидностей болезнетворных бактерий. Учёным удалось создать несколько групп антибиотиков, с помощью которых можно было справиться со всеми возбудителями. Однако в ходе применения антибиотикотерапии выяснилось, что микроорганизмы под действием препаратов способны мутировать, приобретая устойчивость. Причём новые штаммы образуются в каждом поколении бактерий, сохраняя резистентность на генетическом уровне. То есть люди своими руками создали огромное количество новых «врагов», которых до изобретения пенициллина не существовало, и теперь человечество вынуждено постоянно искать новые формулы антибактериальных средств.
ГРУППЫ АНТИБИОТИКОВ
Несмотря на многообразие этой группы препаратов, все их можно отнести к нескольким основным видам. В основе этой классификации лежит химическая структура – лекарства из одной группы имеют схожую химическую формулу, отличаясь друг от друга наличием или отсутствием определенных фрагментов молекул.
Классификация антибиотиков подразумевает наличие групп:
- Производные пенициллина. Сюда относятся все препараты, созданные на основе самого первого антибиотика. В этой группе выделяют следующие подгруппы или поколения пенициллиновых препаратов:
- Природный бензилпенициллин, который синтезируется грибами, и полусинтетические препараты: метициллин, нафциллин.
- Синтетические препараты: карбпенициллин и тикарциллин, обладающие более широким спектром воздействия.
- Мециллам и азлоциллин, имеющие еще более широкий спектр действия.
- Цефалоспорины – ближайшие родственники пенициллинов. Самый первый антибиотик этой группы – цефазолин С, вырабатывается грибами рода Cephalosporium. Препараты этой группы в большинстве своем обладают бактерицидным действием, то есть убивают микроорганизмы. Выделяют несколько поколений цефалоспоринов:
- I поколение: цефазолин, цефалексин, цефрадин и др.
- II поколение: цефсулодин, цефамандол, цефуроксим.
- III поколение: цефотаксим, цефтазидим, цефодизим.
- IV поколение: цефпиром.
- V поколение: цефтолозан, цефтопиброл.
Отличия между разными группами состоят в основном в их эффективности – более поздние поколения имеют больший спектр действия и более эффективны. Цефалоспорины 1 и 2 поколений в клинической практике сейчас используются крайне редко, большинство из них даже не производится.
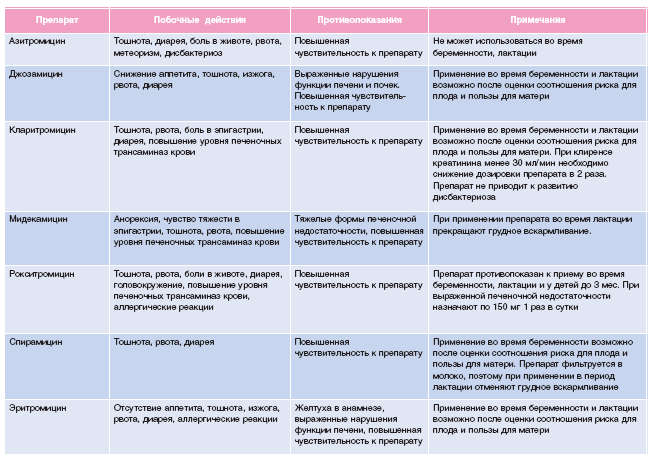
- Макролиды – препараты со сложной химической структурой, оказывающие бактериостатическое действие на широкий спектр микробов. Представители: азитромицин, ровамицин, джозамицин, лейкомицин и ряд других. Макролиды считаются одними из самых безопасных антибактериальных препаратов – их можно применять даже беременным. Азалиды и кетолиды – разновидности макорлидов, имеющие отличия в структуре активных молекул.

Еще одно достоинство этой группы препаратов – они способны проникать в клетки человеческого организма, что делает их эффективными при лечении внутриклеточных инфекций: хламидиоза, микоплазмоза.
- Аминогликозиды. Представители: гентамицин, амикацин, канамицин. Эффективны в отношении большого числа аэробных грамотрицательных микроорганизмов. Эти препараты считаются наиболее токсичными, могут привести к достаточно серьезным осложнениям. Применяются для лечения инфекций мочеполового тракта, фурункулеза.
- Тетрациклины. В основном этой полусинтетические и синтетические препараты, к которым относятся: тетрациклин, доксициклин, миноциклин. Эффективны в отношении многих бактерий. Недостатком этих лекарственных средств является перекрестная устойчивость, то есть микроорганизмы, выработавшие устойчивость к одному препарату, будут малочувствительны и к другим из этой группы.
- Фторхинолоны. Это полностью синтетические препараты, которые не имеют своего природного аналога. Все препараты этой группы делятся на первое поколение (пефлоксацин, ципрофлоксацин, норфлоксацин) и второе (левофлоксацин, моксифлоксацин). Используются чаще всего для лечения инфекций ЛОР-органов (отит, синусит) и дыхательных путей (бронхит, пневмония).
- Линкозамиды. К этой группе относятся природный антибиотик линкомицин и его производное клиндамицин. Оказывают и бактериостатическое, и бактерицидное действия, эффект зависит от концентрации.
- Карбапенемы. Это одни из самых современных антибиотиков, действующих на большое количество микроорганизмов. Препараты этой группы относятся к антибиотикам резерва, то есть применяются в самых сложных случаях, когда другие лекарства неэффективны. Представители: имипенем, меропенем, эртапенем.
- Полимиксины. Это узкоспециализированные препараты, используемые для лечения инфекций, вызванных синегнойной палочкой. К полимиксинам относятся полимиксин М и В. Недостаток этих лекарств – токсическое воздействие на нервную систему и почки.
- Противотуберкулезные средства. Это отдельная группа препаратов, обладающих выраженным действием на туберкулезную палочку. К ним относятся рифампицин, изониазид и ПАСК. Другие антибиотики тоже используют для лечения туберкулеза, но только в том случае, если к упомянутым препаратам выработалась устойчивость.
- Противогрибковые средства. В эту группы отнесены препараты, используемые для лечения микозов – грибковых поражений: амфотирецин В, нистатин, флюконазол.
Антибиотики — принципы действия
У каждого антибиотика в бактериальной клетке есть мишень в виде молекулярной машины, которая состоит или из белков, или более сложная — состоящая из белков и РНК.
Первая мишень — аппарат синтеза клеточной стенки. У бактерии есть жесткая клеточная стенка (состоит из полисахаридов, которые связанны пептидами). Клетки млекопитающих (человека ) такой стенки не имеют. Целая группа антибиотиков (например, пенициллин и их производные) не дает бактериям синтезировать клеточную стенку. Новый антибиотик такого действия — ванкомицин.
Вторая мишень ― фермент ДНК-гираза, который действует на ДНК бактерии. В маленькой бактериальной клетке огромная ДНК должна быть плотно свернута, чтобы она могла поместиться. Именно ДНК-гираза помогает сворачивать компактно ДНК, также этот фермент способствует расхождению цепей двухцепочной ДНК в ходе репликации и транскрипции. На ДНК-гиразу действует природный антибиотик налидиксовая кислота и ее синтетические аналоги фторхинолоны. РНК-полимераза (считыватель генов) — тоже является мишенью некоторых антибиотиков, например, рифампицина.
Третья, самая распространенная мишень для антибиотиков — аппарат биосинтеза белка бактерий. В бактериях (и вообще в любых живых организмах) белки синтезируются рибосомой — это специальная очень крупная молекулярная машина, которая состоит из РНК и белков.
Механизм воздействия антибиотиков на мишени следующий: в структуре мишени есть полости определенной геометрической формы, которые распознают антибиотики, затем встраиваются в них и мешают работе молекулярной машины, например, мешают чему-то связаться с молекулярной машиной или могут заставлять молекулярные машины делать ошибки.
От того антибиотик останавливает работу молекулы или заставляет молекулярную машину делать ошибки будет зависеть антибиотик бактериостатический или бактерицидный.
Бактериостатические антибиотики ингибируют рост бактерий, и если мы уберем антибиотик, то бактерии начнут расти дальше. Бактерицидные убивают бактериальную клетку, и, если мы уберем антибиотик, она не продолжит рост.
Рис. 1. Разные классы антибиотиков и принципы их действия. Светлым цветом выделены препараты с бактерицидным действием, темным с бактериостатическим.
После антибиотиков
Во время лечения антибиотиками доктора нередко назначают препараты — пробиотики, которые будут способствовать восстановлению нормальной микрофлоры кишечника. Зачастую, антибиотики могут нанести урон ее составу. Сам пробиотик, длительность и кратность его приема назначает врач. В некоторых случаях его назначение не нужно. Также докторами рекомендовано соблюдение диеты с исключением жаренного, жирного, копченостей и консервантов. В рационе питания ребенка должно быть как можно больше свежих овощей, фруктов, богатых клетчаткой и витаминами.
Нежелательные реакции
Естественно, на взрослых и детей лекарства могут действовать по-разному: у детей раннего возраста снижена скорость обмена веществ, гематоэнцефалический барьер головного мозга более проницаем, особенно у младенцев, печень и почки находятся в стадии развития, вследствие чего лекарства из организма выводятся быстрее. Некоторые составляющие ЛС могут иметь токсическое влияние – чем меньше ребенок, тем больше вероятность возникновения побочных эффектов. Нежелательные реакции у детей могут проявляться не сразу, а на более поздних стадиях роста и созревания. Неблагоприятное влияние ЛС в детском возрасте может быть связано с их биологическим действием на развитие органов и систем. Широкомасштабные исследования эффективности и безопасности ЛС проводятся и после регистрации ЛС с внесением ограничений на их использование и даже отзывом с фармацевтического рынка. Так, были получены данные о том, что ацетилсалициловая кислота («Аспирин») при вирусных инфекциях у детей может сопровождаться развитием токсической энцефалопатии и жировой дегенерацией печени и головного мозга (синдром Рея); применение нимесулида («Найз») в качестве жаропонижающего — развитием токсического гепатита; применение эритромицина и азитромицина может сопровождаться прокинетическим действием (развитием пилоростеноза у новорожденных); появились сообщения о гепатотоксичности азитромицина и фторхинолонов. В наше время невозможно избежать назначения лекарственных препаратов. Применение же любых лекарственных средств сопряжено с риском побочных эффектов. Известный афоризм гласит, что «есть больные, которым нельзя помочь, но нет таких больных, которым нельзя навредить». Поэтому необходимо всегда взвешивать целесообразность назначения препаратов и риск нежелательных лекарственных реакций, соблюдая основную врачебную заповедь: «Не навреди!».
Антибиотики надо принимать с осторожностью
Даже в самом начале опытов, медики отмечали, что в некоторых случаях пенициллин был неэффективен. Он не действовал на золотистый стафилококк, который вызывает инфекции на коже. С такой же проблемой столкнулись и другие антибиотики. Бактерии начали вырабатывать устойчивость к ним. Поэтому, для лечения некоторых заболеваний, врачам приходится применять сразу несколько видов антибиотиков и других препаратов. Эти лекарства нужно применять строго по инструкции и под контролем лечащего врача
Это важно для сохранения лечебных свойств препарата в будущем
Появление антибиотиков стало огромным скачком в лечении различных инфекций и спасло жизнь миллионам людей на планете.
Правила приёма антибиотиков

лекарство выбирает только врач. Антибиотики имеют огромное число противопоказаний и побочных эффектов, самостоятельное употребление этих лекарств опасно, особенно для детей. Никогда не слушайте советов подруг, лекарство эффективное для одного ребёнка, может принести вред другому малышу. К тому же, перед выбором антибиотика врач назначит необходимые анализы, проведёт тщательный осмотр и опрос пациента.
правильная дозировка. В педиатрии дозировка препарата рассчитывается на килограмм массы тела ребёнка. Поэтому дозировка для детей одного возраста может немного отличаться. Никогда не меняйте дозировку указанную врачом, не удваивайте дозу, чтобы быстрее справиться с инфекцией. Такие эксперименты могут вызывать нежелательные последствия, дисбактериозы и токсические реакции. Не следует уменьшать назначенную врачом дозировку или прекращать раньше времени прием лекарства. Таким образом микроорганизмы полностью не погибают, а наоборот, приобретают устойчивость к препарату. При повторных заболеваниях антибиотик может оказаться неэффективным, придётся пользоваться более серьёзными лекарственными средствами.
Будьте внимательны при покупке суспензии; выпускаются лекарства с различной дозировкой, количеством сухого вещества в 5 мл. Покупайте лекарственные средства строго по рецепту, выписанному врачом;
соблюдайте время и кратность приема. Принимать антибиотик нужно в одно и то же время, соблюдая одинаковые интервалы между приёмом лекарства. Это создаст постоянную концентрацию вещества в крови, поможет быстро справиться с инфекцией. Курс приема обычно составляет от 5 до 7 дней, при тяжелых заболеваниях возможно продление терапии до двухнедельного периода.
запивать лекарство нужно чистой негазированной водой. Строго запрещено запивать лекарственные средства газированными напитками, молоком, соками. Такие жидкости меняют кислотность среды и нарушают всасывание вещества. Не стоит пить антибиотик вместе с другими препаратами, особенно это касается жаропонижающих, противоаллергических и отхаркивающих средств.
Между приемом лекарства и употреблением соков, кислых напитков должно пройти не менее часа;
соблюдать диету. Поскольку на систему пищеварения ложиться повышенная нагрузка, а для выздоровления нужно потреблять достаточный каллораж, стоит отдать предпочтения здоровому питанию. Рекомендуется включать в рацион достаточное количество овощей и фруктов, меньше употреблять рафинированных, консервированных, острых продуктов. Позаботьтесь о достаточной количестве потребляемой малышом жидкости, пусть кроха сам выберет любимый напиток. Тёплое обильное питье поможет разжижить мокроту и уменьшить явления интоксикации.
Существует взаимосвязь между реологическими свойствами крови и вязкостью мокроты. Высокая температура, недостаток жидкости — приводят к обезвоживанию и образованию густой, трудноотделяемой мокроты;
ведите дневник приёма антибиотика. Заведите дневник наблюдения за болеющим малышом, отмечайте повышения температуры, изменения состояния крохи и введённые препараты. Обязательно укажите дату и время первого приёма антибиотика. Рассчитайте временной интервал и придерживайтесь вашего графика приёма противомикробных средств. Будьте внимательны к своему ребёнку, отмечайте все нежелательные реакции, возникшие при лечении недуга. Это поможет быстрее найти причину ухудшения состояния крохи и вовремя принять меры.
Миф. Чтобы вылечиться побыстрее, нужны «сильные» антибиотики широкого спектра действия
Правда. Все зарегистрированные антибактериальные препараты можно смело относить к мощным, то есть «сильным», однако выраженность их противомикробного эффекта зависит от множества факторов, объединенных принципами антибиотикотерапии :
- Установка диагноза настолько точная, насколько это возможно. Знание диагноза позволяет определить предполагаемого возбудителя.
- Определение возбудителя, если это возможно.
- Принятие взвешенного решения о необходимости назначения антибиотиков.
- Подбор оптимального антибиотика с учетом фармакокинетики и спектра активности.
- Подбор оптимальной дозы и курса лечения (последний при большинстве острых инфекций должен составлять не менее 5–10 дней).
- Контроль эффективности антибиотикотерапии.
В российских реалиях, когда контроль за приемом антибиотиков, откровенно говоря, недостаточен, особенно остро стоит вопрос некорректного подбора препаратов. Известно, что его осуществляют двумя способами: этиотропным и эмпирическим. В первом случае антибиотик применяется целенаправленно против определенного, точно установленного возбудителя. Без сомнения, это рационально и оправданно. Однако идентификация микроорганизма, вызвавшего инфекцию, требует времени, обычно это занимает несколько суток. Когда процесс протекает остро и больному требуется немедленная помощь, выделение возбудителя — неоправданная роскошь. В такой ситуации назначают эмпирическую терапию, подбирая препарат с учетом наиболее вероятных возбудителей . Например, самый частый возбудитель пневмонии — пневмококк, цистита — кишечная палочка и так далее.
Если антибиотик был подобран корректно и все остальные принципы антибиотикотерапии были соблюдены, он, без сомнения, окажется «сильным». А вот тот же препарат, применяемый неправильно (независимо от того, на каком этапе была сделана ошибка), может проявить «слабость» и не оказать терапевтического действия.