Мочевина в сыворотке
Содержание:
- Подагра что это за болезнь?
- Стадии почечной недостаточности кошек
- Цистатин С в крови и моче: нормы, преимущества оценки
- Анализ на С-реактивный белок
- Данные по азотистым обменным процессам
- Анализ крови на уровень мочевой кислоты
- Кальций в крови повышен – что это может быть?
- Методы нормализации
- 4.Каковы риски и что может помешать анализу?
- Подготовка к биохимическому анализу крови
- Аминокислоты и белки
- АНА ИЛИ АНТИЦИТОПЛАЗМАТИЧЕСКИЕ АНТИТЕЛА
- Хроническая почечная недостаточность (ХПН)
- 1.Общие сведения
- Что делать?
Подагра что это за болезнь?
Подагра – это воспаление суставов, вызванное отложением
солей мочевой кислоты непосредственно в суставе и вокруг него. По данным The Lancet
распространенность этого заболевания составляет 1-2% населения развитых стран,
в основном мужчин.
Причины, которые вызывают данный наиболее распространенный
вид артрита – это, в первую очередь, генетическая предрасположенность и
диетологические факторы. Именно метаболические нарушения, ведущие к чрезмерной
выработке мочевой кислоты и недостаточному ее выведении, а также питание, перенасыщенное
пуринами, провоцируют гиперурикемию. Это избыточное накопление мочевой кислоты
в крови.
В группу риска входят люди:
- с избыточной массой тела;
- с сахарным диабетом (подробнее о питании при
сахарном диабете); - ишемической болезнью сердца;
- гипертонией;
- хроническими заболеваниями почек;
- с избытком в питании мяса и продуктов из него;
- часто переедающие;
- чрезмерно употребляющие алкоголь, особенно пиво,
а также неалкогольные газированные напитки; - принимающие диуретики, ацетилсалициловую кислоту
и некоторые другие виды лекарств.
Стадии почечной недостаточности кошек
1. Латентная стадия заболевания почек (ранняя).
Характеризуется снижением скорости клубочковой фильтрации, однако это не сказывается на общем состоянии животного и концентрации креатинина в крови
2. Начальная стадия ХПН.
Наблюдается умеренная азотемия, концентрация креатинина в сыворотке крови — до 250 мкмоль/л. Прогрессирование данной стадии заболевания может длиться несколько месяцев, сопровождается снижением аппетита, потерей массы тела, периодической рвотой. Компенсация может вызвать гиперпаратиреоидизм, снижение концентрационной способности почек.
3. Консервативная стадия ХПН.
Происходит дальнейшее снижение скорости клубочковой фильтрации, развивается высокая уремия, концентрация креатинина в сыворотке крови составляет 252 — 440 мкмоль/л. На данной стадии характерна полидипсия, возможно появление клинических признаков обезвоживания анемии, нарушения работы ЖКТ, метаболический ацидоз.
4. Терминальная стадия ХПН.
О терминальной стадии ХПН свидетельствуют не только высокие показатели мочевины и креатинина в крови, но и гипокальциемия (вплоть до развития судорог), симптомы уремической энцефалопатии, гиперфосфатемия, картина декомпенсированного уремического ацидоза (дыхание Куссмауля), интерстициальный отек легких. При длительной тяжелой азотемии жизнь невозможна без диализа или трансплантации почки .
По данным Douglas Slatter есть 3 фазы почечной недостаточности.
1 фаза. Заболевания почек, которые первично повреждают почечную ткань (гломерулонефрит, мочекаменная болезнь, гипертензия). Не оказывает существенного влияния на жизнь животного и не сказывается на концентрации креатинина в крови.
2 фаза. Почечная недостаточность с незначительными клиническими проявлениями. Уровень креатинина 179 – 354 мкмольл.
3 фаза. Уремия, с явными клиническими проявлениями и креатинином крови свыше 354 мкмольл.
В нашей практике мы условно разделили ХПН на три стадии по уровню креатинина в крови:
1. Начальная стадия — когда уровень креатинина не поднимается выше 250 мкмольл – при этом у таких животных может не быть никаких клинических проявлений болезни, или они незначительны. Таких кошек за последний год было 38% (от общего количества кошек страдающих ХПН).
2. Средняя – уровень креатинина крови до 500 мкмольл. Имеются явные клинические признаки заболевания (полиурия, полидипсия, нарушение функции ЖКТ, анемия, истощение). Таких кошек около 28%.
3. Терминальная – уровень креатинина выше 500 мкмольл. Полный набор клинических признаков, вплоть до летаргии. Таких кошек от общего числа страдающих ХПН – 34%.
Цистатин С в крови и моче: нормы, преимущества оценки
Цистатин С представляет собой низкомолекулярный полипептид (сложный белок), который относится к группе ингибиторов (подавляющее реакции в-во) цистеиновой протеазы. Он вырабатывается во всех клетках организма и полностью фильтруется, когда плазма проходит через клубочки.
Это делает показатель чрезвычайно подходящим для оценки клубочковой фильтрации. Доказано, что умеренное повышение цистатина С за счет снижения скорости фильтрации успешно прогрессирует до почечной недостаточности или острого заболевания почек. Кроме этого, этот же показатель выявляет ряд сердечно-сосудистых заболеваний.
Нормы цистатина С не зависят от пола и веса человека — у всех здоровых людей этот белок вырабатывается в примерно равных количествах. Затем он полностью утилизируется почками, поэтому в моче обычно обнаруживаются минимальные количества цистатина С.
При нарушении функции почечных канальцев, концентрация этого белка в моче увеличивается. Это указывает на проблемы.
Значения сывороточного показателя (плазма крови) в норме у человека со здоровыми почками составляют 0,7-1,6 мг/л, тогда как в моче значение ниже 0,2 мг/л.
Таблица: нормы цистацина С в крови, мг/л
| Пол | Возраст | Референсные значения |
| Мужчина | До 1-го мес. | 1,49 – 2,85 |
| 1-5 месяцев | 1,01 – 1,92 | |
| 5 месяцев – 1 год | 0,75 – 1,53 | |
| 1-2 года | 0,77 – 1,85 | |
| 2-19 лет | 0,62 – 1,11 | |
| Старше 19 лет | 0,5 – 1,2 | |
| Женщина | До 1-го мес. | 1,49 – 2,85 |
| 1-5 месяцев | 1,01 – 1,92 | |
| 5 месяцев – 1 год | 0,75 – 1,53 | |
| 1-2 года | 0,6 – 1,2 | |
| 2-19 лет | 0,62 – 1,11 | |
| ОТ 19 лет | 0,5 – 1,2 |
Анализ на С-реактивный белок
С-реактивный белок (СРБ) – очень чувствительный элемент анализа крови, который быстро реагирует даже на мельчайшее повреждение ткани организма. Присутствие С-реактивного белка в крови является предвестником воспаления, травмы, проникновения в организм бактерий, грибков, паразитов.
СРБ точнее показывает воспалительный процесс в организме, чем СОЭ (скорость оседания эритроцитов). В то же время С-реактивный белок быстро появляется и исчезает – быстрее, чем изменяется СОЭ.
За способность С-реактивного белка в крови появляться в самый пик заболевания его еще называют «белком острой фазы».
При переходе болезни в хроническую фазу С-реактивный белок снижается в крови, а при обострении процесса повышается вновь.
С-реактивный белок норма
С-реактивный белок производится клетками печени и в сыворотке крови содержится в минимальном количестве. Содержание СРБ в сыворотке крови не зависит от гормонов, беременности, пола, возраста.
Норма С-реактивного белка у взрослых и детей одинаковая – меньше 5 мг/ л (или 0,5 мг/ дл).
Анализ крови на С-реактивный белок берется из вены утром, натощак.

1
Анализ крови на уровень мочевой кислоты

2
анализ крови на антинуклеарные антитела

3
Исследование крови на ревматоидный фактор
Причины повышения С-реактивного белка
С-реактивный белок может быть повышен при наличии следующих заболеваний:
- ревматизм;
- острые бактериальные, грибковые, паразитарные и вирусные инфекции;
- желудочно-кишечные заболевания;
- очаговые инфекции (например, хронический тонзиллит);
- сепсис;
- ожоги;
- послеоперационные осложнения;
- инфаркт миокарда;
- бронхиальная астма с воспалением органов дыхания;
- осложненный острый панкреатит;
- менингит;
- туберкулез;
- опухоли с метастазами;
- некоторые аутоиммунные заболевания (ревматоидный артрит, системный васкулит и др.).
При малейшем воспалении в первые же 6-8 часов концентрация С-реактивного белка в крови повышается в десятки раз. Имеется прямая зависимость между тяжестью заболевания и изменением уровня СРБ. Т.е. чем выше концентрация С-реактивного белка, тем сильнее развивается воспалительный процесс.
Поэтому изменение концентрации С-реактивного белка используется для мониторинга и контроля эффективности лечения бактериальных и вирусных инфекций.
Разные причины приводят к разному повышению уровня С-реактивного белка:
- Наличие бактериальных инфекций хронического характера и некоторых системных ревматических заболеваний повышает С-реактивный белок до 10-30 мг/л. При вирусной инфекции (если нет травмы) уровень СРБ повышается незначительно. Поэтому высокие его значения указывают на наличие бактериальной инфекции.
- При подозрении на сепсис новорожденных уровень СРБ 12 мг/л и более говорит о необходимости срочной противомикробной терапии.
- При острых бактериальных инфекциях, обострении некоторых хронических заболеваний, остром инфаркте миокарда и после хирургических операциях самый высокий уровень СРБ – от 40 до 100 мг/л. При правильном лечении концентрация С-реактивного белка снижается уже в ближайшие дни, а если этого не произошло, необходимо обсудить другое антибактериальное лечение. Если за 4-6 дней лечения значение СРБ не уменьшилось, а осталось прежним и даже увеличилось, это указывает на появление осложнений (пневмония, тромбофлебит, раневой абсцесс и др.). После операции СРБ будет тем выше, чем тяжелее была операция.
- При инфаркте миокарда белок повышается через 18-36 часов после начала заболевания, через 18-20 дней снижается и к 30-40 дню приходит к норме. При стенокардии он остается в норме.
- При различных опухолях повышение уровня С-реактивного белка может служить тестом для оценки прогрессирования опухолей и рецидива заболевания.
- Тяжелые общие инфекции, ожоги, сепсис повышают С-реактивный белок до огромнейших значений: до 300 мг/л и более.
- При правильном лечении уровень С-реактивного белка снижается уже на 6-10 день.
Подготовка к ревматологическим анализам
Чтобы анализы показывали объективную информацию, необходимо придерживаться некоторых правил. Сдавать кровь нужно в утренние часы, натощак. Между взятием анализов и приемом пищи должно пройти приблизительно 12 часов. Если мучает жажда, выпейте немного воды, но не сок, чай или кофе. Необходимо исключить интенсивные физические упражнения, стрессы. Нельзя курить и употреблять спиртное.
Данные по азотистым обменным процессам
На слишком медленный процесс обмена веществ, голодание, полиурию или печеночную недостаточность укажет занижение креатинина, мочевины, а также мочевой кислоты в составе крови. Нормальные показатели при биохимии крови повышают вероятность проблем с рассматриваемыми заболеваниями.
Возможно и завышение мочевины. Если ее нашли при выполнении биохимии крови, то подозревать будут артериальную гипертензию, наличие отравления или заболеваний почек. Показания выше нормы по мочевой кислоте – признак отравления, течения инфекционных болезней, кожных патологий, подагры, лейкоза или диабета. Одним из признаков отклонений в функционировании почек также является высокий креатинин. Также показатель сигнализирует о сахарном диабете, мышечной дистрофии либо непроходимости в области кишечника.
Анализ крови на уровень мочевой кислоты
Мочевая кислота – это окончательный продукт распада пуринов. Ежедневно человек получает пурины вместе с продуктами питания, преимущественно с мясными продуктами. Затем с помощью определенных ферментов, пурины перерабатываются с образованием мочевой кислоты.
В нормальных физиологических количествах мочевая кислота нужна организму, она связывает свободные радикалы и защищает здоровые клетки от окисления. Кроме того, она так же, как и кофеин, стимулирует клетки головного мозга. Однако повышенное содержание мочевой кислоты имеет вредные последствия, в частности может приводить к подагре и некоторым другим заболеваниям.
Исследование уровня мочевой кислоты дает возможность диагностировать нарушение обмена мочевой кислоты и связанные с этим заболевания.
1
Ревматологическое обследование

2
Ревматологическое обследование
3
Ревматологическое обследование
Когда нужно провести обследование:
- при впервые возникшей атаке острого артрита в суставах нижних конечностей, возникшей без очевидных причин;
- при рецидивирующих атаках острого артрита в суставах нижних конечностей;
- если у вас в роду есть родственники страдающие подагрой;
- при сахарном диабете, метаболическом синдроме;
- при мочекаменной болезни;
- после проведения химиотерапии и/или лучевой терапии злокачественных опухолей (и особенно лейкозов);
- при почечной недостаточности (почки выводят мочевую кислоту);
- в рамках общего ревматологического обследования, необходимого для выяснения причины воспаления сустава;
- при продолжительном голодании, посте;
- при склонности к чрезмерному употреблению спиртных напитков.
Уровень мочевой кислоты
Уровень мочевой кислоты определяют в крови и в моче.
Мочевая кислота в крови называется урекемия, в моче – урикозурия. Повышенное содержание мочевой кислоты – гиперурикемия, пониженный уровень мочевой кислоты – гипоурикемия. Патологическое значение имеет только гиперурикемия и гиперурикозурия.
Концентрация мочевой кислоты в крови зависит от следующих факторов:
- количества пуринов, поступающих в организм с едой;
- синтеза пуринов клетками организма;
- образования пуринов вследствие распада клеток организма из-за болезни;
- функции почек, выводящих мочевую кислоту вместе с мочой.
В обычном состоянии наш организм поддерживает уровень мочевой кислоты в норме. Увеличение ее концентрации так или иначе связано с обменными нарушениями.
Нормы содержания мочевой кислоты в крови
У мужчин и женщин может наблюдаться различная концентрация мочевой кислоты в крови. Норма может зависеть не только от пола, но и возраста человека:
- у новорожденных и детей до 15 лет – 140-340 мкмоль/л;
- у мужчин до 65 лет – 220-420 мкмоль/л;
- у женщин до 65 лет – 40- 340 мкмоль/л;
- у женщин старше 65 лет – до 500 мкмоль/л.
Если превышение нормы происходит в течение длительного времени, то кристаллы соли мочевой кислоты (ураты) откладываются в суставах и тканях, вызывая различные болезни.
Гиперурикемия имеет свои признаки, но может протекать и бессимптомно.
Причины повышения содержания мочевой кислоты:
- прием некоторых лекарственных препаратов, например мочегонных;
- беременность;
- интенсивные нагрузки у спортсменов и людей, занимающихся тяжелым физическим трудом;
- длительное голодание или употребление продуктов, содержащих большое количество пуринов;
- некоторые болезни (например, эндокринные), последствия химиотерапии и облучения;
- нарушенный обмен мочевой кислоты в организме из-за дефицита некоторых ферментов;
- недостаточное выделение мочевой кислоты почками.
Как снизить концентрацию мочевой кислоты
Те, кто болен подагрой, знают, сколько неприятностей может доставить повышенная концентрация мочевой кислоты. Лечение этого недуга должно быть комплексным и обязательно включать прием препаратов, снижающих концентрацию мочевой кислоты в крови (ингибиторы ксантиноксидазы). Рекомендуется употребление большего количества жидкости и снижение потребления продуктов богатых пуринами.
Важно также постепенно избавиться от лишнего веса, поскольку ожирение обычно ассоциируется с повышением мочевой кислоты. Диета должна быть составлена так, чтобы количество продуктов, богатых пуринами было ограничено (красное мясо, печень, морепродукты, бобовые)
Очень важно отказаться от алкоголя. Необходимо ограничить употребление винограда, томатов, репы, редьки, баклажанов, щавеля – они повышают уровень мочевой кислоты в крови. Зато арбуз, наоборот, выводит мочевую кислоту из организма. Полезно употреблять продукты, ощелачивающие мочу (лимон, щелочные минеральные воды).
Кальций в крови повышен – что это может быть?
Теоретически, существует три наиболее вероятные клинические проблемы, которые могут вызывать повышенное содержание кальция в крови. Все возможные причины того, что в крови кальций находится выше нормы, достаточно серьезны.
Первая причина высокого кальция крови – это первичный гиперпаратиреоз, заболевание, сопровождающееся появлением опухоли в одной или нескольких паращитовидных железах (правильнее говорить «околощитовидных железах», но термин «паращитовидные железы» очень широко распространен). Основной задачей паращитовидных желез в организме является поддержание нормального уровня кальция крови. Клетки паращитовидных желез «умеют» ощущать концентрацию кальция в плазме крови и в соответствии от уровня кальция вырабатывать паратгормон. Основное действие паратгормона заключается в повышении уровня кальция в крови (путем разрушения костной ткани и выброса кальция из нее в кровь, а также путем усиления всасывания кальция из первичной мочи в почках и усилении всасывания его из кишечника). При возникновении опухоли в паращитовидной железе ее клетки перестают ощущать концентрацию кальция в крови – им «кажется», что кальция в крови нет, либо он низкий. Клетки опухоли начинают бесконтрольно вырабатывать паратгормон, который резко усиливает распад костной ткани и выделение из нее кальция в кровь. В итоге лабораторно мы определяем повышенный кальций крови и одновременно высокий уровень паратгормона. Чаще всего подобные изменения сопровождаются также снижением уровня фосфора крови и повышением уровня кальция в моче. Опасность заболевания заключается в снижении плотности костной ткани с возникновением склонности к переломам, к деформации костей, снижению роста. Повышенный уровень кальция в крови приводит к отложению солей кальция в стенках сосудов и клапанах сердца, что снижает их эластичность и повышает склонность к тромбозам, а значит – опасность возникновения инсультов и инфаркта миокарда.
Вторая возможная причина повышенного кальция – это распад костной ткани вследствие возникновения в ней метастазов какой-либо злокачественной опухоли. Метастазы оказывают так называемое литическое действие, т.е. разрушают костную ткань и высвобождают из нее соли кальция, которые попадают в кровь и приводят к повышенному содержанию кальция в крови. В этом случае кальций в крови повышен, но одновременно уровень паратгормона находится в пределах нормы или у нижней границы нормы.
Третья возможная причина повышенного содержания кальция в крови
– развитие нейроэндокринных опухолей, вырабатывающих так называемые ПТГ-подобные пептиды. Эти опухоли чаще всего локализуются в легких, хотя их расположение может быть очень разнообразным. Размеры таких опухолей обычно невелики – от 4-5 мм до 1-2 см. Они «умеют» вырабатывать цепочки аминокислот, последовательность которых совпадает с активным концом паратгормона. Подобные пептиды (их называют ПТГ-подобными, поскольку они очень похожи по действию на паратгормон) вызывают ситуацию, когда кальций в крови повышен, однако лабораторные анализаторы не показывают в данном случае повышения уровня паратгормона, поскольку ПТГ-подобные пептиды копируют молекулу паратгормона не полностью.
Методы нормализации
Для коррекции низкого индекса мочевины устраняют причины этого состояния. Когда дисбаланс легкий и непатологический, достаточно:
- скорректировать рацион, увеличив в нем долю белковых продуктов, отказаться от жестких диет;
- обсудите с врачом порядок приема лекарств;
- соблюдать суточное количество потребляемой жидкости.
Но часто в тяжелых случаях назначают лечение.
Медикаментозные методы
Если полностью восстановить индекс мочевины до нормального состояния не удается, его переводят в положение стабильной компенсации.
Для этого следует провести тщательное обследование у узких специалистов — уролога, эндокринолога, терапевта, гастроэнтеролога, инфекциониста, которые помогут выявить причину, имеющую негативное влияние, и назначить соответствующее лечение:
При необходимости назначают препараты, налаживающие обменные процессы, улучшающие деятельность пищеварительной системы.
После окончания терапии тесты повторяются, чтобы оценить эффективность лечения.
Питание и народные способы
Когда уровень мочевины низкий, рекомендуется увеличить количество белка в рационе. Необходимо есть мясо, молочные продукты, рыбу, бобовые.
Это особенно важно для беременных, так как организм работает на двоих.
Любые народные методы являются дополнением к назначенной врачом терапии и не могут применяться без его консультации.
Выяснив причину снижения уровня мочевины, врач при необходимости порекомендует травы и сбор, соответствующий заболеванию — печень, почки, желудок и другие.
4.Каковы риски и что может помешать анализу?
Каковы риски анализа на триглицериды и холестерин?
Возможные риски анализа крови на холестерин и триглицериды могут быть связаны только с самим забором крови. В частности, появление синяков на месте пункции и воспаление вены (флебит). Тёплые компрессы по нескольку раз в день избавят вас от флебита. Если вы принимаете разжижающие кровь препараты, то возможно кровотечение в месте пункции.
Что может помешать анализу холестерин и триглицериды?
Анализу на холестерин и триглицериды могут помешать:
- Приём таких препаратов, как диуретики, кортикостероиды, андрогены, транквилизаторы, эстрогены, противозачаточные, антибиотики, витамин В3;
- Физическая перенагрузка – инфекция, перенесённая операция, инфаркт;
- Приём пищи за 9-12 часов до теста;
- Такие болезни, как гипотиреоз, диабет, болезни печени и почек;
- Злоупотребление алкоголем или наркотиками, или резкое прекращение их употребления;
- Беременность.
О чём стоит знать?
Хиломикроны – другой тип липопротеинов, они измеряются отдельно. Хиломикроны в крови помогают перемещать жир из кишечника в печень. Они также доставляют триглицериды в мышцы для немедленного использования.
Подготовка к биохимическому анализу крови
Для того чтобы результаты анализа были точными, сдавать кровь на биохимию следует натощак. Лучше всего это сделать утром. Если утром не получается, то следует спланировать так, чтобы перед сдачей крови на анализ не есть и не пить ничего, кроме воды, в течение хотя бы 6-ти часов.
Накануне анализа не надо есть жирную пищу и принимать алкоголь. В течение часа перед сдачей анализа желательно не курить.
Если Вы принимаете какие-либо лекарственные препараты, об этом следует известить лечащего врача. Если приём лекарства прерывать нельзя, исследование, возможно, придётся отложить.
Непосредственно перед сдачей анализа желательно присесть и находиться в покое 10-15 минут, чтобы исключить влияние физических и эмоциональных нагрузок на результаты исследований.
Аминокислоты и белки
Белок часто снижается во время голодания или при соблюдении диет, но может говорить о ряде патологий: хронические кровотечения, проблемы с процессами обмена, анемия. Заниженные данные – норма в период грудного вскармливания, в процессе вынашивания малыша (поздние сроки), для лежачих больных или в случае значительных физических нагрузок.
Расшифровка сданных анализов при проведении биохимии крови рассматривается внимательно и нормальные показатели не должны быть превышены. Белок в чрезмерном количестве присутствует у лиц с аутоиммунными заболеваниями, во время инфекций, в случае значительных патологий почек или при наличии опухолей злокачественной категории.
Сниженный уровень аминокислот – плохой показатель, наблюдающийся при проблемах в обменных процессах, часто в результате обнаруживаются проблемы почек или печени.
АНА ИЛИ АНТИЦИТОПЛАЗМАТИЧЕСКИЕ АНТИТЕЛА
— системная красная волчанка (СКВ), — ревматоидный артрит,- синдром Шегрена, — склеродермия,- дерматомиозит,- узелковый периартериит и др.;
- Инфекции (туберкулез, инфекционный мононуклеоз, острый и особенно хронический вирусный гепатит, подострый инфекционный эндокардит, ВИЧ-инфекция и др.);
- Хронический аутоиммунный гепатит, первичный билиарный цирроз печени;
- Сахарный диабет (инсулинзависимый);
- Множественный склероз;
- Легочной фиброз;
- Системные васкулиты.
Антинуклеарные антитела также могут выявляться при острых и хронических лейкозах, приобретенной гемолитической анемии, болезни Вальденстрема, малярии, хронической почечной недостаточности, тромбоцитопениях, лимфопролиферативных заболеваниях, миастении и тимомах.Титры антинуклеарных антител при узелковом периартериите могут достигать 1:100, при дерматомиозите — 1:500, СКВ — 1:1000 и выше. При СКВ тест на выявление антинуклеарных антител методом непрямой иммунофлюоресценции обладает высокой степенью чувствительности (до 98% по данным разных авторов), но умеренной специфичностью (78%), так как антинуклеарные антитела могут встречаться и при других, указанных выше, заболеваниях. Для сравнения, тест определения антител к нативной ДНК с помощью ИФА в диагностике СКВ обладает значительно меньшей чувствительностью — 38% (т.к. патогенетическую роль в развитии СКВ могут играть не только антитела к ДНК, но и антитела к гистонам, дезоксирибонуклеопротеину и многим другим ядерным антигенам); однако специфичность определения антител к нативной ДНК для диагноза СКВ является почти абсолютной (98%). Клиническая интерпретация этих различий в чувствительности и специфичности разных лабораторных тестов в диагностике СКВ выглядит следующим образом: отрицательный результат обнаружения антител к нативной ДНК с помощью ИФА не исключает диагноз СКВ, обнаружение же этих антител практически со 100% вероятностью подтверждает диагноз. Другая ситуация имеется в отношении АНФ: отрицательный (особенно многократный) результат обнаружения антинуклеарных антител методом непрямой иммунофлюоресценции делает диагноз СКВ (во всяком случае, активной формы) весьма сомнительным (т.к. метод обнаруживает практически все аутоантитела, встречающиеся при СКВ), обнаружение же антинуклеарных антител не всегда будет достаточным основанием для постановки диагноза СКВ, оно подтверждает наличие феномена аутоиммунитета и обычно требует для установления окончательного диагноза дальнейшей клинико-лабораторной дифференциации с учетом типа свечения, титра антител, проведения дополнительных уточняющих или подтверждающих тестов, рекомендованных лабораторией, сопоставления результатов с клинической картиной.При СКВ корреляция между величиной титра ANA и клиническим состоянием обычно отсутствует, хотя сохранение высоких титров в течение длительного времени является неблагоприятным прогностическим признаком. Снижение уровня антител предвещает ремиссию, но иногда — летальный исход (феномен потребления антител: при нарастающем аутоиммунном повреждении тканей темп высвобождения ядерных антигенов, с которыми связываются наработанные антиядерные антитела, превышает скорость синтеза новых аутоантител).При склеродермии частота выявления антител к ядерным антигенам составляет 60-80%, их титр обычно ниже, чем при СКВ. При ревматоидном артрите часто встречаются СКВ-подобные формы течения, поэтому довольно часто выявляются ANA. При дерматомиозите антитела к ядерным антигенам в крови встречаются в 20-60% случаев, при узелковом периартериите — в 17% (титр до 1:100), при болезни Шегрена — в 56% в сочетании с артритом и в 88% случаев — при комбинации с синдромом Гужеро-Шегрена. При дискоидной (кожной) красной волчанке антинуклеарный фактор выявляется у 50% больных.Частота обнаружения антинуклеарных антител при ревматическихзаболеваниях и у здоровых лиц (Насонова В.А. и др., 1997)
| Заболевание | Частота выявления ANA, % | Титры |
| СКВ — активная форма | 98-100 | +++ |
| Дискоидная красная волчанка | 40 | ++, +++ |
| Лекарственная волчанка | 100 | ++ |
| Системная склеродермия | 70 | ++, +++ |
| Синдром Шегрена | 60 | ++, +++ |
| Смешанное заболевание соединительной ткани | 100 | ++, +++ |
| Болезнь Рейно | 60 | ++, +++ |
| Ревматоидный артрит | 40 | +, ++ |
| Ювенильный хронический артрит | 20 | +, ++ |
| Полимиозит и дерматомиозит | 30 | + |
| Узелковый периартериит | 17 | + |
| Здоровые лица до 40 лет | 3 | + |
| Здоровые лица после 40 лет | 25 | + |
Хроническая почечная недостаточность (ХПН)
В опыте нашего ветеринарного центра подтверждаются данные приведенные Di Bartola. Среди наших пациентов также преобладали животные старше 7 лет, самцы и самки встречались с одинаковой периодичностью.

В ветеринарных клиниках кошек с ХПН среди всех пациентов от 10 до 30% . В нашей клинике кошек с ХПН на терапевтическом отделении порядка 28-30% от общего количества пациентов.
Этиология
ХПН развивается там, где есть давние, необратимые повреждения почек, вследствие чего они теряют свою экскреторную (выведение продуктов обмена), регулирующую (поддержка объема и состава жидкости в организме) и эндокринную функции (выработка гормонов ренина, эритропоэтина и др.).
Причинами ХПН являются первичные или вторичные ренальные процессы, которые, как правило, продолжаются длительное время и приводят к конечной стадии – сморщенной почке. Такие как:
- поликистоз почек (наследственное заболевание, в основном у персидских и экзотических кошек),
- воспалительные заболевания почек (пиелонефрит, гломерулонефрит),
- болезни обмена веществ (сахарный диабет кошек и собак, амилоидоз),
- мочекаменная болезнь,
- врожденное недоразвитие почек (гипоплазия)
- опухоли почки — например, лимфома,
- другие причины — например, повреждение почек токсинами.
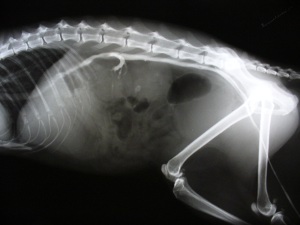
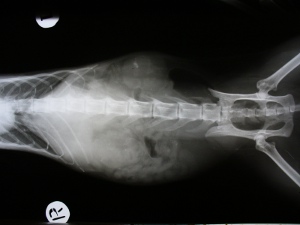
На фото: Поликистоз почек, болезни почек у кошек. Исследование контрастным веществом Омнипак 300.
Однако, в большинстве случаев, точная причина заболевания кошек неизвестна.
Патогенез
В патогенезе ХПН, независимо от почечной патологии, снижение почечных функций происходит за счет 3-х основных механизмов:
- уменьшения количества функционирующих нефронов,
- значительного снижения скорости фильтрации в каждом отдельном случае без уменьшения числа нефронов,
- сочетания первого и второго механизмов.
Следствием действия каждого из этих факторов будет снижение скорости клубочковой фильтрации — скорость, с которой происходит фильтрация веществ из крови через клубочки нефронов. Уменьшение числа функционирующих нефронов постепенно приводит к существенному изменению биохимических показателей крови и тяжелым обменным нарушениям.
Отмечается развитие уремии с накоплением потенциальных токсинов и продуктов метаболизма белков: мочевины (более 10 ммольл ), креатинина (более179 ммольл ), мочевой кислоты.
По современным представлениям синдром уремической интоксикации обусловлен не задержкой азотистых шлаков, а главным образом накоплением в крови средних молекул — белковых веществ, имеющих молекулярную массу от 300 до 500 дальтон, образующихся в результате нарушения гомеостатической функции почек .
Повышение в крови продуктов азотистого метаболизма — осмотически активных веществ — увеличивает осмотическую нагрузку на оставшиеся нефроны. Эти вещества, профильтровавшись в клубочках, в меньшей мере, чем в норме, реабсорбируются в канальцах. Нереабсорбировавшаяся часть их выделяется с мочой вместе с соответствующим количеством воды. Это называется осмотическим диурезом. За счет осмотического диуреза общее выделение почками воды не только сохраняется нормальным, но даже может быть увеличенным (полиурия), несмотря на значительное снижение клубочковой фильтрации. Плотность мочи при этом снижается и становится стабильной на уровне 1,008—1,015, что соответствует плотности крови и указывает на снижение концентрационной способности почек.
Полиурия приводит к потере организмом воды (дегидратация). При дегидратации снижается почечный кровоток, ухудшается клубочковая фильтрация и усугубляется ХПН. При ХПН нарушается метаболизм кальция и фосфора. По мере прогрессирования ХПН падают выделение кальция с мочой и его всасывание в кишечнике, содержание фосфатов в крови повышается. Указанные нарушения сопровождаются изменениями в костной ткани — остеодистрофией. Нарушения обмена электролитов приводят к изменениям в нейромышечной системе, сопровождающимся адинамией, параличами и другими нарушениями. ХПН сопровождается изменениями во всех видах обмена веществ. На ранних стадиях нарушается энергетический обмен -расходование энергии превышает возможности энергообразования.
1.Общие сведения
Калий – один из ключевых макроэлементов в организме человека. Это вещество, особенно во взаимодействии с натрием, необходимо для регуляции сократительной активности мышц (в т.ч. миокарда), водно-солевого, кислотно-щелочного и энергетического баланса, высшей нервной деятельности, нормальной ферментации и метаболизма, секреторной активности эндокринных желез, функционирования печени и почек. До половины всех солей в организме – соединения калия, и основной их объем содержится во внутриклеточных жидких пространствах.
В отношении всех микро- и макроэлементов, калия в том числе, должен соблюдаться определенный интервал концентрации.
В противном случае как дефицит, так и избыток приводит к развитию тяжелых, порой жизнеугрожающих состояний. Гиперкалиемия, т.е. чрезмерное содержание калия – типичный тому пример.
Что делать?
Чтобы получить достоверные результаты анализа на иммуноглобулин Е, стоит подготовиться к сдаче крови правильно.
- Определение Ig E производится только в пик обострения болезни при наличии очевидных симптомов: сыпь и жжение, заложенность носа, насморк. Иначе анализ ничего не покажет.
- Накануне сдачи анализа необходимо вести пищевой дневник, учитывая и наличие симптомов. Это поможет врачу-аллергологу сделать более точные выводы и назначить подходящую панель.
- Для подтверждения аллергического характера воспаления в некоторых случаях стоит сдать анализ на катионный протеин эозинофилов.